| . | 화 학 적 세 척 법 | 기 계 적 세 척 법 | ||
| 세정성 이용(A) | 용해성 이용(B) | 화학반응 이용(C) | (D) | |
| 종류 | 1. 알카리성 염 2. 계면활성제 3. 1,2의 병용 4. 2와 용제병용 (Emulsion Cleaner) |
1. 석유계 용제 2. Tar계 용제 3. 염소화탄화수소 4. 극성용제 5. 유화성 용제 6. 이상(二相) 청정 |
1. 산 2. 수동태화된 산 3. 유기산 4. 계면활성제(1~3병용) 5. 알카리제 청정 6. 용융 알카리법 |
1. 닦는법 2. 흡착법 3. Barrel 연마 4. Grind 연마 5. Frame |
| 적용방법 | 1. 침적 2. 스프레이 3. 붓질 4. 전해 5. 초음파 6. 증기 탈지 7. 닦는법 8.Barrel,Screw Conveyer |
1. 침적 2. 붓질 3. 스프레이 4. 초음파 5. 증기 탈지 6. 닦는법 |
1. 침적 2. 스프레이 3.Barrel,Screw Conveyer 4. 전해 5. 초음파 6. 닦는법 |
1. 압축 공기 2. 물 3. 동력 4. 열 5. 인력(연마석 및 공구를 사용한다) |
| 세척기구 | 1. 흡착 2. 가용성 3. 분산 4. 유화 5. 검화 6. 오물재부착 방지 |
1. 용해 2. 침투 |
1. 화학반응에 의한 가용화 2. 전해 작용 |
1. 연삭 2. 충격 3. 팽창 |
| 적용성 | 1. 모든 종류의 오물 2. 친수성 표면 요구 3. C, D의 전처리 4. B의 후속처리 5. 고도의 청정성 |
1. 다량의 중질유 2. A, C, D의 전처리 3. 친수성 표면 불필요 4. 물사용 불가 5. 신속성이 필요할 떄 |
1. Scale 제거 2. 녹 제거 3. 수동태화 동시 처리 4. 산 가용성 오물 5. 평활화,광택화 |
1. Scale 제거 2. 녹 제거 3. 바리 제거, 손상 4. A~C로 제거 곤란한 오물 5. 접착, 도장 전처리 |
| 장점 | 1. 경제적 2. 유지, 수용성 오물 및 불용성 오물 제거 3. 친수성 표면 4. 각종 오물에 따라 다양한 종류가 있다 5. 화재 위험성이 없다 6. 보통 폐수처리가 용이 |
1. 오물 제거 신속 2. 저온 사용 3.특정오물(탄화물, 땜납 및 바니쉬)에 최적 4. 용제 증발 제거 5. 중성 6. 녹발생 위험 적다 7. 금속을 침해하지 않음 |
1. 경제적 2. D에 비하여 덜 힘듬 3. D에 비하여 다량을 동시에 처리함 4. 숙련이 불필요 5. 표면 평활 |
1. 완전성 2. 신속성 3. 대상에 대한 선택성이 없음 (금속 재질, 형상) 4. 세정과 동시에 다른 작용 |
| 단점 | 1. 처리 시간이 길다 2. 고온 3. 기계적 조작을 필요로 하는 경우가 많다. |
1. 비교적 고가 2. 소수성 피막 3. 화재 위험성 4. 인체 유해성 5. 수용성 오물 부적합 6. 특별한 장치 필요 7. 폐액 처리 필요 |
1. 산 사용할 때 녹 발생 2. 사용 약품의 인체에 대한 장애 3. 금속에 대한 부식성 4. 수소취성 5. 대상 금속 선택 |
1. 장치 고가 2. 다수의 작업자 필요 3. 금속 표면이 거칠어짐 4. 장치 유지비가 크다 |
 액체 및 고체가 공기 모양의 기체와 접촉하고 있을 때 그 계면을 액체 또는 고체의 표면 이라고 말한다. 물체의 표면은 자유 에너지의 장이지만 모양이 비교적 불안정한 액체의 표면으로부터 분자가 자유로이 비산 되지 않는 것은 외부로부터 작용되는 압력 이외에 분자 상호 간에 존재하는 흡인력, 즉 Van Der Wall's의 힘에 의해 물질의 안쪽 방향으로도 인력이 작용하기 때문이다. 액체의 표면에 존재하는 분자는 그림 1에 나타난 모양으로 분자간의 안쪽방향으로 흡인하기 때문에 표면장력이 생기고, 이 장력에 의해 액체의 표면이 유지하게 된다. 표면 장력은 계선 1cm에 작용하는 힘, dyne으로 표시된다.
액체 및 고체가 공기 모양의 기체와 접촉하고 있을 때 그 계면을 액체 또는 고체의 표면 이라고 말한다. 물체의 표면은 자유 에너지의 장이지만 모양이 비교적 불안정한 액체의 표면으로부터 분자가 자유로이 비산 되지 않는 것은 외부로부터 작용되는 압력 이외에 분자 상호 간에 존재하는 흡인력, 즉 Van Der Wall's의 힘에 의해 물질의 안쪽 방향으로도 인력이 작용하기 때문이다. 액체의 표면에 존재하는 분자는 그림 1에 나타난 모양으로 분자간의 안쪽방향으로 흡인하기 때문에 표면장력이 생기고, 이 장력에 의해 액체의 표면이 유지하게 된다. 표면 장력은 계선 1cm에 작용하는 힘, dyne으로 표시된다. | 물질 | 표면장력 (dyne/cm) | 물질 | 표면장력 (dyne/cm) |
| Water Ammonia Ethyl Alcohol Olive Oil Glycerin Benzol Paraffin |
72.75 23.40 22.30 32.00 63.40 28.88 26.40 |
석유원유 Pennsylvania La Jolla Naphta Tar Oil 윤활유(오클라마산) |
24 ~ 26 35 ~ 38 19 ~ 23 34 ~ 97 36 ~ 37 |
| 온도(℃) | 0 | 10 | 18 | 20 | 30 | 40 | 60 | 80 | 100 |
| 표면장력 dyne/cm | 75.64 | 74.22 | 73.00 | 72.75 | 72.18 | 69.59 | 66.18 | 62.61 | 58.85 |
| 액체 | 온도(℃) | 계면장력 | 액체 | 온도(℃) | 계면장력 |
| Benzene Ethyl Ether Aniline Nitrobenzene Chloroform 사염화탄소 |
19 18 15 15 18 15 |
34.4 10.6 43.8 24.7 33.3 43.8 |
n-Butyl Alcohol Carpron 산 Octyl Alcohol Laulyl 산 Olein 산 |
25 20 18 16 60 20 |
1.8 5.2 8.2 8.7 10.5 15.7 |
| 세척 | 화학적 작용 | 알카리 작용 | 비누화 작용 유화,분산 작용 상승 작용 |
| 계면활성제 작용 | 습윤,침투 작용 유화,분산 작용 기포,소포 작용 | ||
| 기계적 작용 |
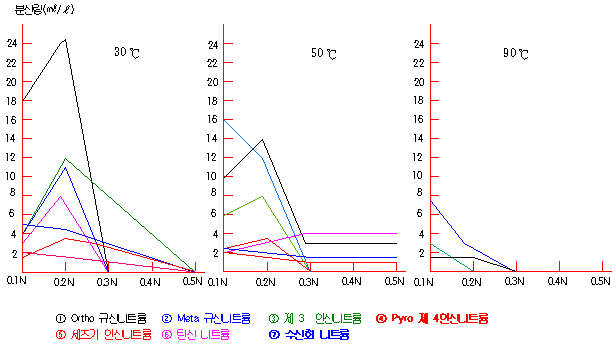
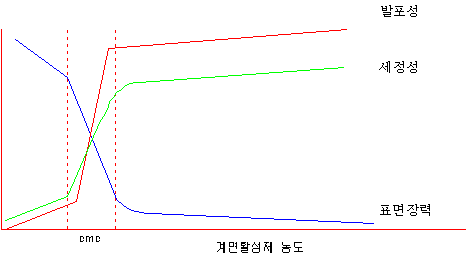
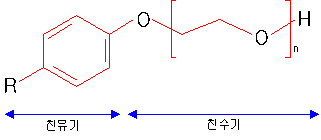
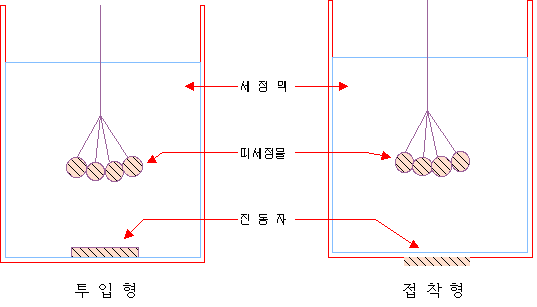
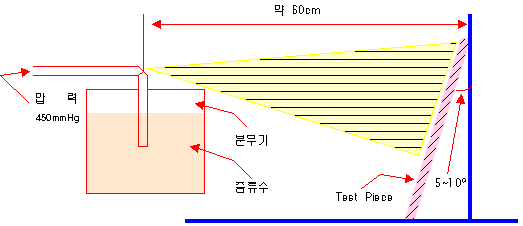
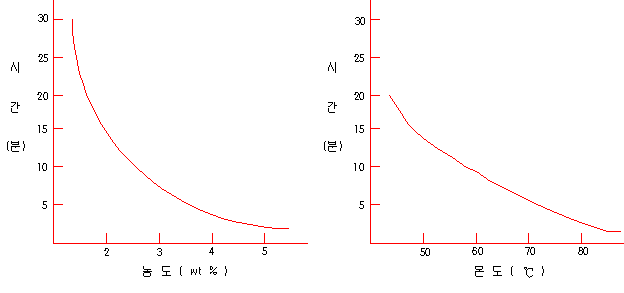
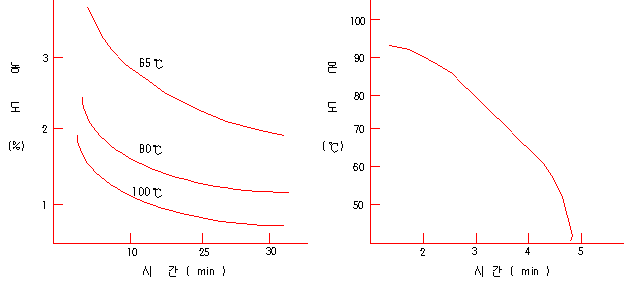
| 산의 종류 | 농도(%) | 각 온도에서의 산세 시간 (분) | ||
| 18℃ | 40℃ | 60℃ | ||
| 염산 | 5 | 55 | 15 | 5 |
| 10 | 19 | 6 | 2 | |
| 황산 | 5 | 135 | 45 | 13 |
| 10 | 120 | 32 | 18 | |